新冠檢測類型大不同
從新冠病毒爆發之初,到現今本澳疫情趨於穩定,新冠病毒檢測成了功臣之一。透過針對不同人群、採集方式和樣本數量,新冠檢測能夠幫助醫護人員排查出確診新冠的患者,並在療程結束後檢驗病患是否痊癒。
隨着疫情管控政策的發展,新冠檢測和採集的方式種類也越來越多,平常在新聞報道中都提及“單採”、“混採”、“單檢”和“混檢”,很多民眾都會對於它們產生疑惑。究竟這些方式有何異同?哪一個適合一般民眾進行檢驗?準確性又有甚麼差別呢?
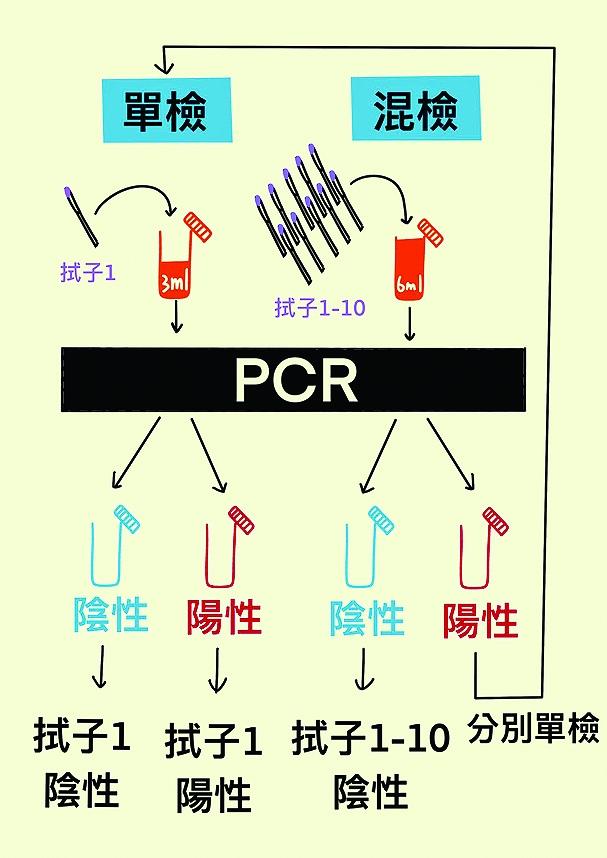
首先概述一下整個新冠病毒檢測流程,主要有兩部分,一個是採樣,另一個是檢測。採樣形式可分為“單採”和“混採”。顧名思義,單採就是指採集單個樣本,強調採集的過程中,一個人佔用一個採集管,一支拭子配用一個採集管。那邊廂,“混採”與單採不同,混採是在採集過程中,混合多個樣本。在醫護人員將拭子放入鼻腔或咽喉後,接下來多個受試者的拭子會放入同一個採集管中。混採又跟據放入同一採集管的拭子數分為五合一混採、十合一混採和二十合一混採。混採的過程中,因為各樣本未經稀釋,所以檢測出病毒的準確度是同等的。若該樣本呈陰性,即代表混採的十個受試者全數陰性。若樣本呈陽性,則衛生部門會召回十位居民再次進行單採,以確定陽性個案。國務院救治組為對混採方法有統一標準,於二○二○年八月和二○二二年一月分別發佈《關於印發新冠病毒核酸十合一混採檢測技術規範的通知》和《關於印發新冠病毒核酸二十合一混採檢測技術規範的通知》,內容指出,根據單採和混採,需要不同份量的保存液。一般而言,單採保存液為三毫升,混採保存液為六毫升。與此同時,根據《澳門特別行政區應對大規模新冠肺炎疫情應急處置預案(第一版)》指出,本澳一般以十合一混採方式進行新冠檢測。
至於檢測形式,總括可以理解為經過樣本前處理後,樣本進入即時聚合酶連鎖反應(Real-time PCR,簡稱RT-PCR)進行檢測的過程。一般分為“單檢”和“混檢”。前者將採集管會作為一個獨立樣本進行檢測,依據檢測試劑盒上要求的份量將原始樣本加入試劑中進行核酸提取。單檢是疫情初期針對高風險人群、隔離人士和新冠感染患者病程監測的檢測方式。那邊廂,後者所配合採集方式與單檢相同,都是以一個人一個採集管為單位,但在放入試劑盒前會進行稀釋,多個人佔用一個檢測通道,核酸提取完畢後再進行擴增。但混檢是在混採還未出台前的次要方案,現在已經基本不會使用了。
那麼,檢測數值又有甚麼影響?由於“單採”和“單檢”沒有涉及到保存液的稀釋,靈敏度相同;“混採”則由於保存液稀釋一倍,驟眼看靈敏度相差一半,但對於平時新聞報道所提及CT值(循環閥值)而言,只增加一個單位(理想情況)。但如果十採一過程,有兩個陽性樣本,則靈敏度與“單採”和“單檢”一樣。至於“混檢”方面,由於進入RT-PCR之前,檢測人員需要按試劑盒要求,將每支保存液稀釋到特定體積。以十合一混檢為例,每支保存液都要稀釋十倍後上機,若其中一個為陽性樣本,則檢出的CT值(理想值)會比單採單檢時增加約三單位。所以不管混採或混檢,一旦發現陽性,衛生當局都會對混合樣本的受試者進行單獨隔離,並進行單採單檢。
檢測過程中會涉及人員、儀器、物料、方法和環境,當確保到採樣人員採樣到位、檢測儀器順利操作。檢驗試劑的靈敏度越高,檢測方法無誤和環境沒有污染下,單採和混採都能夠檢測出病毒,其準確程度大致相同。需要注意的是,想要提高新冠檢測的準確度,更重要的是檢驗試劑的靈敏度(靈敏度越高,就能夠檢測出病毒濃度越低的樣本),同時還有檢驗前的樣本前處理等各種因素。因此,透過混採達到多次篩查,更可以提高準確性。
培正基因工程小組組長 劉千悅