全球首個有助評價藥效測試疫苗及致病機制
鍾南山團隊建新冠小鼠模型
【本報記者廣州十二日電】鍾南山團隊與多個中外團隊合作,應用表達新冠病毒受體人ACE2的腺病毒轉導小鼠,快速建立全球首個新冠肺炎非轉基因小鼠模型。該研究成果已於六月十日在線發表於國際頂級期刊《細胞》。
可作疫苗研究
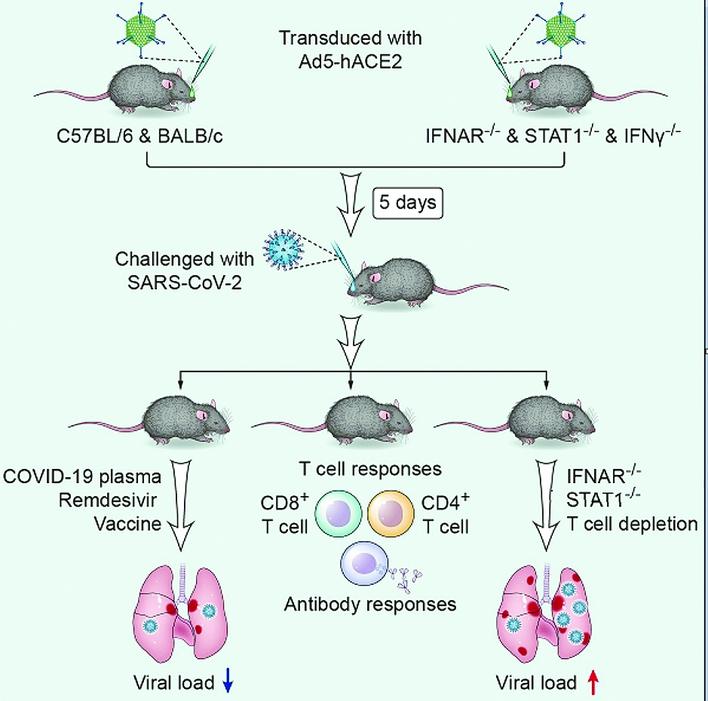
呼吸疾病國家重點實驗室教授趙金存今日在廣州市政府疫情發佈會上透露,在鍾南山院士指導下,該團隊與廣州海關技術中心國家生物安全檢測重點實驗室(P3實驗室)、美國愛荷華大學、廣州再生醫學與健康廣東省實驗室、中國科學院廣州生物醫藥與健康研究院等團隊完成模型建立,可以應用於新冠治療藥物效果評價、疫苗效果測試及新冠致病機制等多方面研究。
廣州在疫情早期的二月初已完成毒株分離,但由於氨基酸關鍵位點差異,小鼠同源受體mouse ACE2不能介導病毒入侵。傳統受體轉基因小鼠模型雖然可作為新冠肺炎研究動物,但由於保有量有限,繁育耗時長,臨床症狀不典型,造成我國新冠肺炎診療方案、藥物、疫苗和致病機制體內驗證嚴重滯後。
研究成果顯示,團隊利用腺病毒載體,在小鼠肺臟轉導表達hACE2,成功解決上述科學難題,建立國際首個非轉基因新冠肺炎小鼠動物模型。小鼠在感染新冠病毒後,肺臟中可檢測到高滴度新冠病毒,每克組織中病毒滴度可達一千萬PFU,並出現體重下降和類似新冠肺炎病人的臨床病理表現。
周期短技術簡
進一步通過對比野生型小鼠與Ⅰ型干擾素受體缺陷小鼠和干擾素通路關鍵基因STAT1敲除小鼠在新型冠狀病毒感染後的差異,發現Ⅰ型干擾素在新冠病毒感染中起到保護作用。
此外,在此模型中,新冠病毒感染可誘導機體產生強烈的病毒特異性T細胞應答及體液免疫應答。更為重要的是該研究團隊利用此小鼠模型評價了新冠感染康復者血漿和瑞德西韋對新冠病毒感染的治療作用。結果顯示,給予血漿治療和藥物組的小鼠肺臟病毒滴度均明顯降低,且病理損傷減輕。
本模型相比傳統受體轉基因小鼠模型,構建周期短,僅需二至三周,不需要特殊繁育,可用於多種基因修飾小鼠動物模型構建。且技術方法簡單,易於重複,適宜大規模推廣,有利於抗病毒藥物、抗體、疫苗的應急驗證及致病機制研究,並已給多家單位共享,有效緩解了新冠肺炎動物模型缺乏的難題。